Ora spiego, ma prima qualche concetto:
Stati della materia (o stato di aggregazione delle molecole): classificazione degli stati che può assumere la materia a seconda delle proprietà meccaniche che manifesta.
Introduco quindi il concetto di bagnabilità: La tendenza di una goccia ad appiattirsi sulla superficie aumenta al diminuire dell'angolo di contatto, perciò l'angolo di contatto è una misura inversa della bagnabilità delle superfici. Il grado di bagnabilità è dipendente dalla tensione superficiale del liquido e dalle varie energie di interfaccia.
Il fenomeno della bagnabilità, riveste significativa importanza nella cosmetologia in quanto la preparazione di formulazioni in sospensione richiede che le particelle che costituiscono la fase dispersa siano avviluppate (completamente bagnate) dal liquido per potervisi disperdere.
Per trattare quantitativamente il fenomeno della bagnabilità, consideriamo una goccia di liquido depositata su una superficie solida
Dopo aver riunito nel punto di contatto delle tre fasi aria-liqudo-solido i vettori caratterizzanti le forze superficiali (che sono tangenti alle rispettive superfici), li proiettiamo parallelamente alla superficie del solido in modo da poter formulare la condizione di equilibrio:
Dalla condizione di equilibrio, si ricava la relazione di Young.
Questo significa che quando una goccia di liquido è posta su una superficie solida, il suo perimetro si sposta, allargandosi o contraendosi, fino a quando l'angolo θ assume il valore dato dall’ equazione .
La bagnabilità è correlata con la misura dell'angolo θ . I 4 casi possibili:
- materia allo stato solido (volume e una forma propria, es PELLE)
- materia allo stato liquido (volume proprio, forma del recipiente che lo contiene, es. ACQUA)
- materia allo stato aeriforme (non ha né volume né forma propria, ma si espande fino a occupare tutto lo spazio disponibile, es. ARIA)
- materia allo stato plasmatico (non ha forma propria ma può espandersi come un aeriforme)
Consideriamo un recipiente con un liquido:
Una molecola come quella indicata con la lettera A è circondata da altre molecole simili che la attraggono. La molecola A, sotto l’azione di tali forze, tenderà a spostarsi un poco nella direzione della molecola più prossima, ma manterrà, in media nel tempo, la propria posizione.
Una molecola come la B, che si trova sulla superficie del liquido, sentirà anch’essa la forza attrattiva esercitata dalle molecole vicine, ma queste si trovano soltanto sotto o accanto alla molecola considerata. Ne consegue che la molecola B è attratta più efficacemente verso l’interno del liquido stesso . Per questo motivo il liquido si comporta come se ci fosse una pellicola invisibile, una membrana elastica, che lo tiene unito.
Introduco quindi il concetto di bagnabilità: La tendenza di una goccia ad appiattirsi sulla superficie aumenta al diminuire dell'angolo di contatto, perciò l'angolo di contatto è una misura inversa della bagnabilità delle superfici. Il grado di bagnabilità è dipendente dalla tensione superficiale del liquido e dalle varie energie di interfaccia.
Il fenomeno della bagnabilità, riveste significativa importanza nella cosmetologia in quanto la preparazione di formulazioni in sospensione richiede che le particelle che costituiscono la fase dispersa siano avviluppate (completamente bagnate) dal liquido per potervisi disperdere.
Per trattare quantitativamente il fenomeno della bagnabilità, consideriamo una goccia di liquido depositata su una superficie solida
Questo significa che quando una goccia di liquido è posta su una superficie solida, il suo perimetro si sposta, allargandosi o contraendosi, fino a quando l'angolo θ assume il valore dato dall’ equazione .
La bagnabilità è correlata con la misura dell'angolo θ . I 4 casi possibili:
1. la bagnabilità è massima quando l’angolo è uguale a zero, θ = 0 (cosθ = 1); è dovuta ad una bassa tensione superficiale del liquido, ad una bassa tensione interfacciale e ad una grande tensione superficiale del solido. E' quello che si verifica, per es., quando l'olio si spande sul vetro.
2. la bagnabilità è parziale quando θ < 90° (cos θ < 1).
La figura a destra, mostra che quando l'angolo θ è minore di 90° allora la bagnabilità è parziale ed aumenta con il diminuire di θ, diventando massima per θ = 0°.
Questa situazione si presenta quando
ed è
particolarmente evidente quando la tensione superficiale del liquido è elevata:
un esempio è il film lacrimale su una lente a contatto.
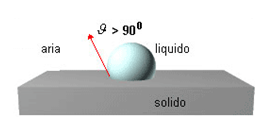
3. la bagnabilità è scarsa quando θ > 90 (cos θ
< -1)
Si verifica se
4. Non si ha bagnabilità quando θ = 180° (cos θ = - 1). Un esempio si ha nel caso di mercurio su vetro.
p.s.L’acido salicilico ha un angolo di 103 e l'acqua ha una tensione superficiale più grande della maggior parte dei liquidi, a causa del legame idrogeno che si instaura tra le sue molecole.












chiaro anche a chi, come me, non ha mai studiato chimica
RispondiEliminal'obiettivo era rendere i concetti semplici :)
Elimina